올겨울 내내 힘들었던 독감, 인플루엔자 바이러스….
- Posted at 2019/03/02 22:44
- Filed under 생물정보

언제부터인지 우리는 쌀쌀해진 기온이 코끝을 스치면 독감 예방주사를 맞고 겨울을 준비한다. 독감은 일반적인 감기와는 달리 전염성이 매우 크고 폐렴으로 이어지는 경우가 많아 일반인들에게도 다르게 인식되어 있다. 그도 그럴 것이 감기는 서로 다른 여러 종류의 바이러스들로 유발되지만, 독감은 '인플루엔자 바이러스'라는 명확한 질병체가 밝혀져 있고 그 치료제도 개발되어 있다. 그런데 왜 매번 다른 독감 예방접종을 하고, 증상이 조금씩 다를까? 그 이유는 매우 똑똑한 진화를 거듭하며 스스로 변화하고 있기 때문이다.
인플루엔자 바이러스 구조
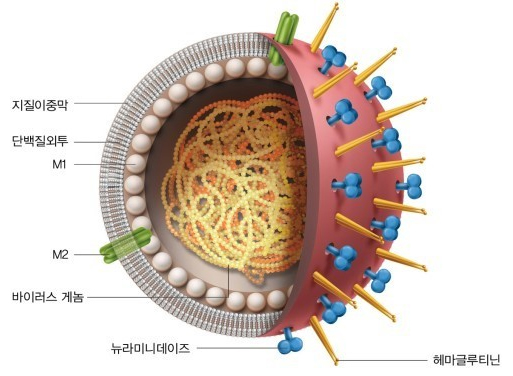
[그림 1] 인플루엔자 바이러스의 구조
(출처 : 이일하 교수의 생물학 산책, 이일하)
독감 인플루엔자 바이러스는 nucleocapsid (NP)와 matrix (M) 단백질의 차이에 의해 크게 A, B 및 C형으로 구분된다. 이중 잦은 변이를 일으키며 사람에게 질병을 유발하는 것은 A형으로 바이러스 표면에 존재하는 헤마글루티닌(HA)과 뉴라미니데이즈 (NA)의 다양한 조합으로 그 형태를 변화시키고 있다. 현재 밝혀진 헤마글루티닌의 sub-type은 16개(H1~H16), 뉴라미니데이즈의 sub-type은 9개(N1~N9)로 대략적인 조합수를 생각해 봐도 144개의 다른 인플루엔자바이러스가 만들어질 수 있음을 알 수 있다. 그러나 더욱 문제가 되는 부분은 이러한 조합을 통한 변이 발생이 사람만을 숙주로 하는 것이 아니라 조류와 돼지에서도 발생이 되고, 서로 공유되어 더 다양한 변이가 발생할 수 있다는 것이다. 현재까지 보고에 의하면 사람에서는 주로 A/H3N2형, A/H1N1형 및 B형이 유행하고 있는데 변이를 통해 새로운 바이러스 주가 출현할 경우 유병률과 사망률이 많이 증가하는 것으로 보고되고 있다. 때문에, WHO를 중심으로 전 세계 인플루엔자 감시체계가 운영 중이며 그 유전자형을 밝혀 백신주와 처방제를 제시하는 등 유행에 대비하고 있다.
그렇다면 어떻게 올해 유행할 백신주를 제시하는 걸까?
일반적으로 WHO는 매해 2월 해당연도에 유행할 백신주를 제시하고 있는데, 이는 지난해 남반구에서 가장 유행한 A형 바이러스 2종류와 B형 바이러스 1종을 선정하여 북반구 지역의 나라들에 제시한다. 이를 백신화 한 것이 3가 백신이고, 여기에 B형 1종을 추가한 것이 4가 백신이 된다. 참고로, B형은 2개의 sub-type이 존재하는데, 이 중 한 종류의 항체만 가져도 나머지 한 종에 대한 방어를 어느 정도 수행할 수 있으므로 3가 백신만으로도 충분할 수 있다. 또한, 예방 접종 후 항체 형성은 2주, 효과는 6개월 정도 지속된다고 한다.
바이러스의 유전자형은 어떻게 판별되는 것일까?
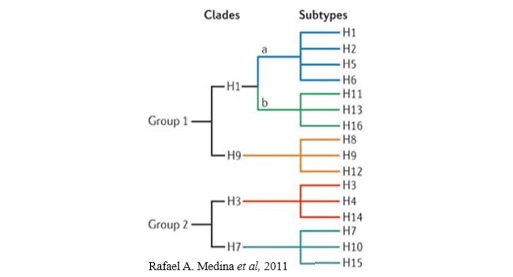
유행하는 바이러스의 유전자형은 qRT-PCR을 통해 빠르게 확인한다. 이때, NP, M 또는 HA 유전자를 증폭시켜 유전자 염기 서열을 비교 분석 하게 된다. 각 sub-type은 재조합 변이에 따라 서로 유사 정도가 다른데, 그림 2와 같이 크게 두 그룹으로 구분되어 진다. 이러한 유전자 변이 정도에 따르면 H1, H2, H5, H6의 경우 모두 H1에서 변형된 형태로 볼 수 있다. 이러한 정보는 이후 임상학적 표현형이나, 숙주(사람, 조류, 돼지 등)의 기원을 예측할 수 있고, 나아가 예방, 예찰의 자료로 활용된다.
독감 즉 신종플루 치료제 타미플루의 기작은 어떻게 될까?
인플루엔자 바이러스는 숙주세포의 표면에 sialic acid를 포함한 receptor에 부착한 후 8개의 segments로 구성된 바이러스 유전체를 숙주세포의 세포질로 밀어 넣는다. 이때, 세포막 일부가 유입된 유전체 서열의 막을 형성하는 엔도좀을 형성하게 된다. 형성된 엔도좀 내부는 낮은 pH를 유지하게 되는데, 이로 인해 바이러스의 lipid layer, 즉, 껍질이 분해되고 바이러스 핵산이 세포질에 노출되게 된다. 노출된 핵산중 heterotrimeric influenza polymerase (FluPol)를 코딩하는 유전체만이 숙주세포의 핵 안으로 이동하게 된다. 이후 숙주세포의 polymerase CTD (c-terminal domain)를 인지하여 바이러스의 유전자를 역전사시키고 복제시킨다. 절대적으로 숙주 세포의 시스템을 활용하여 바이러스 유전자를 대량 복제시키는 시스템으로 이를 cap-snatching 이라 하며, 이로 인해 숙주 세포의 유전자가 발현되지 않는 것을 host shut-off라 한다.
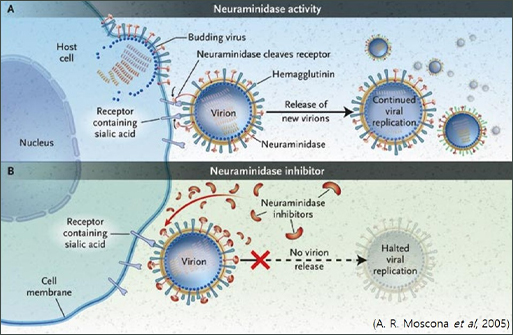
숙주세포의 시스템을 이용해 다량 생산한 바이러스 단백질들은 다른 세포로의 이동을 위해 virus particle을 형성하고 숙주세포로 부터 떨어져 나와 다른 세포로 확산된다. 이때, 바이러스는 HA와 NA를 표면에 이미 배치하고, 숙주 세포의 표면에 존재하는 sialic acid와 HA가 최종 결합되는 구조를 형성한다. 이후 NA(neuraminidase)는 근처의 HA와 sialic acid 결합을 끊어 세포로부터 분리 되게 한다. 타미플루는 이러한 바이러스 생활사 중 NA의 활성을 억제하여 다른 세포로의 확산을 방지하는 방법으로 바이러스에 대응하고 있어야 한다. 바이러스의 증식은 일반적으로 감염 후 48시간 이내에 모두 이뤄진다. 따라서 타미플루의 복용은 감염 후 48시간 이내에 이뤄져야 NA 활성을 낮춰 세포 내 확산을 막을 수 있다.
작성 : RDC 신윤희 센터장
Posted by 人Co
- Tag
- Bioinformatics, insilicogen, 인실리코젠
- Response
- No Trackback , No Comment
- RSS :
- https://post-blog.insilicogen.com/blog/rss/response/306
Trackback URL : 이 글에는 트랙백을 보낼 수 없습니다


